水と油が交わらない理由について
油と水が交わらない理由は、分子の性質の違いにあります。
🔬 簡単に言うと…
- 水は「極性分子」
- 油は「無極性分子」
この違いが、油と水が混ざらない原因です。
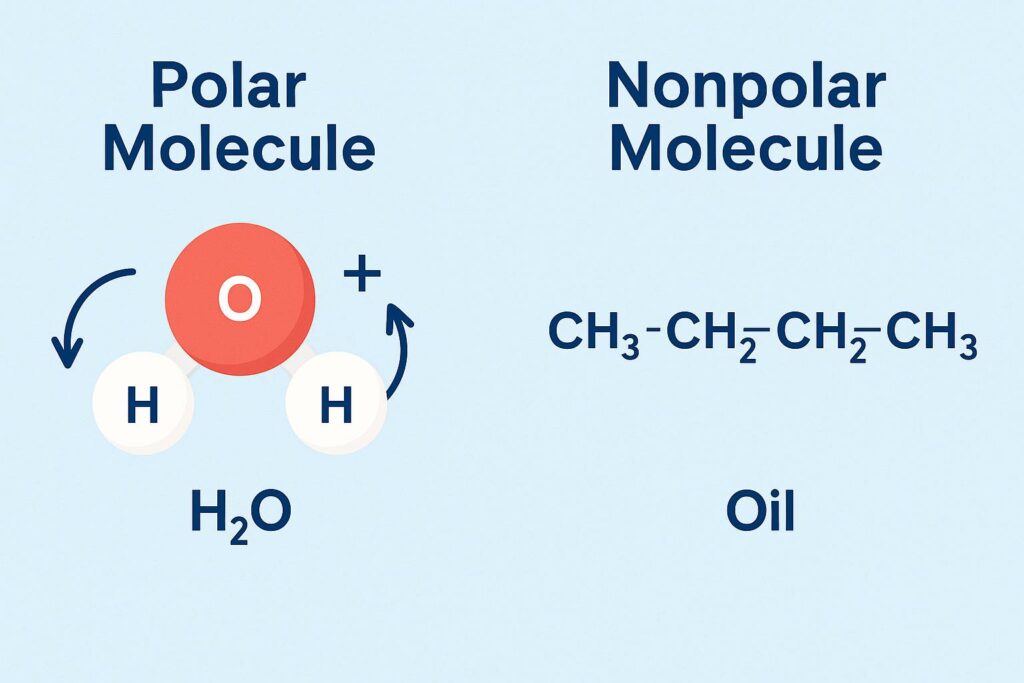
🌊 水の特徴:極性がある
水(H₂O)の分子は、酸素と水素の電気的な引っぱり合いの差によって、プラスとマイナスの電荷が偏っている=極性を持っています。
この極性のある分子同士は、お互いに引き合う(「水素結合」など)ため、水同士はよく混ざります。
🛢️ 油の特徴:極性がない
油の分子(例:植物油、動物性脂肪など)は、電荷の偏りがほとんどない=無極性分子です。
無極性分子同士は引き合うことができますが、極性分子(=水)とは引き合わず、はじき合う性質があります。
🤝 結果として…
水と油はお互いに引き合わないので、混ざらず、分離してしまうのです。
🧪補足:混ぜる方法はある?
「乳化(にゅうか)」という方法を使えば、一時的に混ぜることができます。
例:マヨネーズでは、卵黄に含まれる「レシチン」が油と水をつなぐ「界面活性剤」の役割を果たしています。
油分子の極性がないとはどういうこと?
簡単に言うと、
🔍 電気のかたより(=極性)がない、ということです。
🧲【まず、極性ってなに?】
「極性(きょくせい)」とは、分子の中で電気のかたより(+や−の偏り)があるかどうかを表す言葉です。
- 例えば、水(H₂O)の分子では、
- 酸素(O)は電子を強く引っぱる性質(電気陰性度)がある
- 水素(H)は電子をあまり引っぱらない
- そのため、酸素のまわりは**−(マイナス)っぽくなり**、水素のまわりは**+(プラス)っぽくなる**
- 結果、水分子は「電気がかたよった分子=極性分子」になる
🛢️【油分子はどう違うの?】
油はたいてい、**炭素(C)と水素(H)**がたくさんつながった構造をしています(例:C₁₈H₃₆O₂ など)。
- 炭素と水素の間では、電子の引っぱり合いがほとんどなく、
- 分子全体としても、電気的にかたよらずバランスがとれている
- つまり、「プラス側・マイナス側がはっきりしていない=極性がない」のです。
🎨イメージ図(文字で表現)
極性分子(水)
H(+) — O(−) — H(+)
→ 電気が O 側にかたよる
無極性分子(油)
CH₃ — CH₂ — CH₂ — CH₂ — ...(ずっと同じような構造)
→ 電気のかたよりがない
まとめ
| 分子の種類 | 電気のかたより | 引き合う性質 | 例 |
|---|---|---|---|
| 極性分子 | ある(+/−) | 極性同士で引き合う | 水、アルコール |
| 無極性分子 | ない(均等) | 無極性同士で集まる | 油、ガソリン |
イラストにするとこんな感じでしょうか? Polar Molecule=極性分子 Nonpolar Molecule=無極性分子